Həyat üçün elementlər
“Təbiət qanunlarının gördüyümüz kainatı meydana gətirmək üçün necə də fövqəladə şəkildə tənzimləndiyini gördüyünüz vaxt kainatın öz-özünə meydana gəlmədiyini, arxasında bir məqsədin olmalı olduğunu görürsünüz”. (İngilis fiziki Con Polkinhorn )
Bura qədər yaşadığımız kainatın bütün fiziki tarazlığının bizim həyatımız üçün xüsusi olaraq tənzimlənmiş olduğunu araşdırdıq. Kainatın ümumi quruluşunun, planetimizin bu kainatdakı yerinin, onun fiziki xüsusiyyətlərinin, havanın, işığın və suyun, tam olaraq bizim ehtiyac duyduğumuz xüsusiyyətlərə sahib olduqlarını gördük. Lakin bir də bütün bunlardan savayı, sahib olduğumuz bədəni meydana gətirən elementləri də araşdırmalıyıq. Əlimizi, gözlərimizi, saçımızı, ağciyərlərimizi təşkil edən və ya bizə qida təmin edən bütün canlıları, bitkiləri, heyvanları, ağacları, quşları təşkil edən elementlər də, xüsusi yaradılmış təməl elementlərdir.
Fizik Robert Klarkın: "Yaradıcı həyatın yaradılması məqsədiylə istifadə olunmaq üçün xüsusi hissələr yaratmışdır" şəklindəki sözüylə85 ifadə etdiyi kimi, Allah həyatın təməl elementlərini çox xüsusi və üstün xüsusiyyətlərlə yaratmışdır.
Bu təməl elementlərin ən mühümü isə karbondur.
Karbonun quruluşu
Əvvəlki hissələrdə dövri cədvəldə altıncı yerdə yerləşən karbonun qırmızı nəhəng adlandırılan böyük ulduzlarda nə qədər fövqəladə proses nəticəsində əmələ gətirildiyini araşdırmışdıq. Karbonun bu qədər fövqəladə şəkildə əmələ gəlməsini kəşf edən Fred Hoylun: "ulduzların daxilində həyata keçiridikləri nəticələrə baxılarsa fizika qanunları şüurlu surətdə nizamlanmışdır" dediyinə də şahid olmuşduq.
Karbonu araşdırdığımız vaxt bu atomun təkcə əmələ gəlməsinin deyil kimyəvi xüsusiyyətlərinin də tənzimləndiyi görərik.
Karbon təbiətdə saf halda iki müxtəlif formada mövcuddur, belə ki, qrafit və ya almaz olaraq. Amma etdiyi birləşmələr çox müxtəlif maddələr meydana gətirir. Hüceyrə membranından ağac qabığına, göz büllurundan maral buynuzlarına, yumurta ağından ilan zəhərinə qədər olduqca fərqli olan üzvi maddələrin hamısı karbon əsaslı birləşmələrdən ibarətdir. Karbon: hidrogen, oksigen və azot atomlarıyla müxtəlif həndəsi formalarda birləşərək olduqca müxtəlif maddələr əmələ gətirir.
Karbon birləşmələrinin bəziləri yalnız bir neçə atomdan meydana gəldiyi halda, bəzilərində minlərlə hətta milyonlarla atom var. Təkcə karbon atomları bu qədər uzun və daimi birləşmələr əmələ gətirirlər. Devid Berninin “Həyat” (“Life”) adlı kitabında qeyd olunduğu kimi: "karbon, çox qeyri-adi bir elementdir... Karbon və onun bu qeyri-adi xüsusiyyətləri olmasaydı dünyada həyatın olması qeyri-mümkün olardı".
İngilis kimyagər Nevil Sicvik “Kimyəvi elementlər və birləşmələr” (“Chemical Elements and Their Compounds”) başlıqlı kitabında karbon haqqında bunları yazır:
“Karbon edə bildiyi birləşmələrin sayı və müxtəlifliyi cəhətdən, digər elementlərdən tamamilə fərqlənən özünəxüsusi quruluşdadır. İndiyə qədər karbonun yarım milyondan çox müxtəlif birləşməsi ayırd edilmiş və adlandırılmışdır. Lakin, bu belə karbonun gücü haqqında çox qeyri-kafi məlumat verir, çünki karbon bütün canlı maddələrin bünövrəsini meydana gətirir”.
Həyatın karbon əvəzinə başqa bir elementə əsaslanması isə fiziki və kimyəvi xüsusiyyətlərdən ötrü qeyri-mümkündür. Bir vaxtlar karbona alternativ olaraq ortaya atılan silikonun etibarsız namizəd olduğu isə artıq məlum olmuşdur. Sicvik: "həyatın təməli olaraq, silikonun karbonun yerini tutacağı bir dünya düşüncəsinin qeyri-mümkün olduğundan artıq əmin olacaq qədər məlumata sahibik" deyirdi.
Kovalent rabitələr
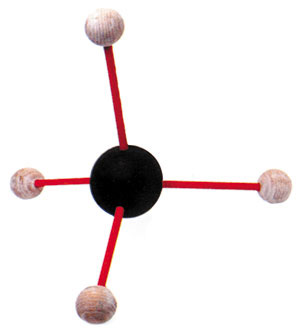 Karbon üzvi birləşmələri yaratmaq üçün başqa atomlarla birləşdiyi vaxt atomlar arasında yaradılan rabitə "kovalent rabitə" adlandırılır. Kovalent rabitə iki atomun elektronlarını bölüşmələri ilə yaradılır.
Karbon üzvi birləşmələri yaratmaq üçün başqa atomlarla birləşdiyi vaxt atomlar arasında yaradılan rabitə "kovalent rabitə" adlandırılır. Kovalent rabitə iki atomun elektronlarını bölüşmələri ilə yaradılır.
Elektronlar atom nüvələrinin ətrafında müəyyən orbitlərdə yerləşirlər. Nüvəyə ən yaxın orbitdə yalnız iki elektron yerləşə bilər. Növbəti orbit səkkiz elektron qəbul edər. Daha sonrakı 18 elektron qəbul edər və bu beləcə davam edər. Maraqlı budur ki, atomlar, orbitlərindəki elektron saylarını tamamlamağa çalışırlar. Məsələn, ikinci orbitində 6 elektron olan oksigen, bu orbitə iki elektron da əlavə edib sayı 8-ə çatdırmaq istəyər. Atomlar niyə belə etməyə çalışdıqları sualını cavablandırmaq mümkün olmur, lakin bu olmasa canlı orqanizmlərin mövcud ola bilməyəcəyi aydındır.
Kovalent rabitələr atomların bu "orbit tamamlama" istəyi sayəsində yaradılır. Hər ikisi də, yəni orbitlərini tamamlamaq istəyən iki fərqli atom, elektronlarını bölüşərək bu tamamlama prosesini həyata keçirir. Məsələn, suyu (H2O) meydana gətirən iki hidrogen və bir oksigen atomu, kovalent rabitə yaradarlar. Oksigen, iki hidrogendəki bir elektronu bölüşərək ikinci orbitindəki elektron sayını 8-ə çatdırar. Hidrogenlərin hər biri də, oksigenin elektronlarından birini alaraq öz orbitlərindəki elektron sayını ikiyə tamamlayar.
Karbon da məhz bu cür kovalent rabitələr yaradaraq çox müxtəlif maddələr əmələ gətirər. Metan bunlardan biridir. Metan dörd ayrı hidrogen atomunun karbonla kovalent rabitə yaratması sayəsində meydana gələr. Karbonun atom sayı (6) oksigenin atom sayından (8) iki vahid az olduğu üçün, karbon iki əvəzinə dörd hidrogenlə rabitə yaradar.
Lakin karbon, başda ifadə etdiyimiz kimi, çox sayda rabitələr yaradar. Karbonun təkcə hidrogenlə yaratdığı müxtəlif rabitələr "karbohidrogenlər" kimi tanınan böyük qrupu meydana gətirər. Bu böyük qrup daxilində isə təbii qaz, maye neft, neft, kerosin və maşın yağları var. Etilen və propilen kimi tanınan karbohidrogenlər isə neft-kimya sənayesinin əsasıdır. Başqa karbohidrogenlər benzol, toluol və skipidar kimi birləşmələr meydana gətirər. Pal-paltarımızı güvələrdən qorumaq üçün şkaflara qoyduğumuz naftalin isə digər bir karbohidrogendir. Xlor və ya flüorla birləşən karbohidrogenlər isə anesteziya maddələri, yanğın söndürücülər və soyuducularda istifadə edilən freon kimi fərqli maddələr əmələ gətirirlər.
Karbonun hidrogen və oksigenlə yaratdığı kovalent rabitələr isə çox sayda müxtəlif maddələr əmələ gətirər. Bunlar arasında etanol və propanol kimi spirtlər, aldehidler, ketonlar və yağ turşuları var. Eləcə də, karbon, hidrogen və oksigen birləşmələrindən meydana gələn çox mühüm iki maddə isə yediyimiz qidalardakı enerjini təmin edən qlükoza və fruktozadır. Ağacın sərt maddəsini və kağızın xammaddəsini meydana gətirən sellüloza, bal mumu, sirkə və qarışqa turşusu kimi maddələrin hər biri, yenə karbonun hidrogen və oksigenlə yaratdığı kovalent rabitələr sayəsində meydana gəlir.
Karbon hidrogen, oksigen və azot atomları ilə rabitələr yaratdıqda isə bu dəfə də, yenə çox əhəmiyyətli birləşmələr əmələ gələr. Bu birləşmələrin başında, bədənimizin təməl elementi olan zülalları əmələ gətirən amin turşuları gəlir. DNT-ni meydana gətirən nükleotidlər də, yenə karbon, hidrogen, oksigen və azot birləşməsindən meydana gələn molekullardır.
Bir sözlə karbon atomunun yaratdığı kovalent rabitələr, həyatın mövcud ola bilməsi üçün, mütləq lazım gələn şərtlərdən biridir. Əgər karbon oksigen, azot və hidrogenlə kovalent rabitələr yaratmasa, həyatdan bəhs etmək qeyri-mümkün olar.
Karbonun bu rabitələri yarada bilməsini təmin edən şey isə onun, kimyaçıların "metastabil" adlandırdıqları xüsusiyyətindən irəli gəlir. Tanınmış biokimyaçı C.B.S. Holdeyn bu xüsusiyyəti belə açıqlayır:
“Bir molekulun metastabil olması onun müəyyən çevrilmə vaxtı sərbəst enerji yarada bilməsi, lakin istilik, radiasiya və ya müəyyən katalizatorla birləşmə vəziyyətlərini çıxmaq şərtilə sabit vəziyyətdə qala bilməsi deməkdir”.
Bu texniki tərif karbon atomunun çox özünəməxsus quruluşa sahib olduğu deməkdir. Bu xüsusi quruluş sayəsində karbon əsasən çox asanlıqla kovalent rabitə yarada bilir.
Lakin burada çox maraqlı bir xüsus var. Karbonun həyat üçün zəruri olan "metastabil" xüsusiyyəti yalnız çox kiçik temperatur intervalı üçün qüvvədədir. Temperatur 100 ⁰C-ni keçdikdə karbon birləşmələri olduqca qeyri-stabil hal alır.
Bunu hamımız gündəlik həyatımızda müşahidə edərik. Əti bişirərkən etdiyimiz şey, əslində, karbon birləşmələrinin quruluşunu dəyişdirməkdir. Lakin mühüm bir xüsusa diqqət yetirilməlidir: bişən ət, artıq tamamilə "ölü" vəziyyətə gəlir, yəni canlı orqanizmlərdə istifadə olunan quruluşundan fərqlənməyə başlayır. Necə ki, əksər karbon birləşmələri 100 ⁰C-dən yüksək temperaturda korlanırlar. Vitaminlərin böyük hissəsi dərhal parçalanır. Şəkərlər eyni şəkildə quruluş dəyişikliyinə məruz qalır və qida dəyərlərini itirirlər. Bir qədər də yüksək temperaturda, məsələn, 150⁰ C-də, karbon birləşmələri yanmağa başlayır.
Yəni karbon birləşmələrinin kovalent rabitələr yaradıb bu rabitələri daimi qoruya biləcəkləri temperatur intervalının yuxarı sərhədi, 100 ⁰C-ni keçməz. Aşağı sərhəd isə 0 ⁰C-dir. 0 ⁰C-dən aşağı temperaturda isə üzvi biokimyanın varlığı qeyri-mümkün olur.
Lakin digər birləşmələr belə deyil. Qeyri-üzvi maddələrin əksəriyyəti temperatur dəyişmələrindən bu şəkildə təsirlənmirlər. Bunu görmək üçün bir parça ətlə yanaşı, bir qədər metal, şüşə və ya daş qoyub bu qarışığı qızdıra bilərsiniz. İstilik artdıqca ətin quruluşunu dəyişdirdiyini, qarardığını və sonunda siə, yandığını görəcəksiniz. Lakin metal, şüşə və ya daş üçün, istiliyi yüzlərlə dərəcə artırsanız da, onlara heç nə olmaz.
Diqqət edirsinizsə, karbon birləşmələrinin kovalent rabitələri yaratmaq və qorumaq üçün ehtiyac duyduqları temperatur intervalı, tam olaraq Yer kürəsində mövcud olan temperatur intervalıdır. Halbuki daha əvvəl də ifadə etdiyimiz kimi, kainatdakı temperatur göstəriciləri, ən isti ulduzlardakı milyardlarla dərəcəlik temperaturla, "mütləq sıfır" nöqtəsi olan -273,15 ⁰C arasında dəyişə bilər. Lakin insan üçün yaradılmış yer kürəsi tam olaraq həyatın təməl elementi olan karbon birləşmələrinin ehtiyac duyduğu kiçik temperatur intervalına malikdir.
Daha da diqqətçəkici xüsus isə eyni temperatur intervalının suyun maye halında olduğu yeganə temperatur intervalı olmasıdır. Əvvəlki fəsildə araşdırdığımız kimi, həyatın əsas şərtlərindən biri olan su tam olaraq karbon birləşmələrinin ehtiyac duyduğu temperatura ehtiyac duyur. Belə bir uyğunluğu zəruri edən bir təbiət qanunu isə yoxdur. Bu, suyun, karbonun və yer kürəsinin xüsusiyyətlərinin bir-birlərinə uyğun şəkildə yaradıldığının əlamətidir.
Zəif rabitələr
Canlı bədənlərindəki atomları bir yerdə saxlayan yeganə rabitələr kovalent rabitələr deyil. Başqa bir rabitə daha var. Fərqli növləri olan bu rabitələr birlikdə "zəif rabitələr" adlandırılır.
Zəif rabitələr, kovalent rabitələrdən təxminən iyirmi qat daha zəifdir. Amma üzvi kimya üçün çox böyük əhəmiyyətə malikdirlər. Canlı bədənlərinin təməl elementi olan zülallar, mürəkkəb üç ölçülü formalarına zəif rabitələr sayəsində sahib olurlar.
Bunu izah etmək üçün zülalların quruluşuna toxunulmalıdır. Zülallar əsasən "amin turşusu zəncirləri" kimi tanınır. Bu düzgün tərifdir, lakin qeyri-kafidir. Çünki "amin turşusu zənciri" tərifi boyunbağındakı mirvari dənələri kimi ardıcıl düzülmüş iki ölçülü düzülüşü xatırladır. Lakin zülalları əmələ gətirən amin turşuları, bir ağacın müxtəlif budaqlarındakı yarpaqların mövqeyi kimi üç ölçülü formaya sahibdirlər.
Kovalent rabitələr amin turşularını əmələ gətirən atomları bir yerdə saxlayarlar. Zəif rabitələr isə amin turşularını lazımi üç ölçülü forma üçün birləşdirərlər. Zəif rabitələr olmasa zülallar mövcud ola bilməz. Zülalların olmadığı bir mühitdə isə canlı aləmindən danışıla bilməz.
İşin qəribə tərəfi isə zəif rabitələrin də ehtiyac duyduqları temperatur intervalının eynilə kovalent rabitələr kimi yenə Yer üzündə mövcud olan temperatur intervalı olmasıdır. Halbuki zəif rabitələrlə kovalent rabitələrin quruluşları bir-birindən tamamilə fərqlidir, eyni temperatura ehtiyac duymalarını tələb edən heç bir normal səbəb yoxdur. Buna baxmayaraq, hər iki rabitə sinfi də eyni temperatur intervalında qurula bilər. Əgər kovalent rabitələrlə zəif rabitələr müxtəlif temperatur intervallarında yaransaydılar yenə zülallar yaradıla bilməzdi.
Karbon atomunun fövqəladə xüsusiyyətləri ilə əlaqədar araşdırdığımız bütün bu məlumatlar, həyatın əsas vəsaiti olan bu atomla, həyatın digər bir əsas vəsaiti olan su və həyatın məskəni olan Yer planeti arasında çox böyük uyğunluq olduğunu göstərir. Maykl Denton “Təbiətin taleyi” adlı kitabında bu həqiqəti belə vurğulayır:
Kainatdakı böyük temperatur intervalı arasında təkcə kiçik bir temperatur intervalı vardır ki, bu intervalda 1) maye halındakı suya, 2) metastabil xüsusiyyətinə malik çoxlu bol və müxtəlif üzvi birləşmələrə və 3) mürəkkəb molekulların üç ölçülü formalarını daimi edən zəif rabitələrə sahibik.
Bu kiçik temperatur intervalı isə bir qədər əvvəl ifadə etdiyimiz kimi, məlum olan bütün göy cisimləri arasında yalnız Yer kürəsində mövcuddur. Üstəlik, həyatın iki mühüm təməl elementi olan karbon və su, Yer kürəsində olduqca bol miqdarda mövcuddurlar.
Bütün bunlar, karbon atomunun və onun fövqəladə xüsusiyyətlərinin həyat üçün xüsusi olaraq meydana gətirildiyini, Yer kürəsi planetinin isə karbon əsaslı həyat üçün xüsusi olaraq yaradıldığını göstərir.
Oksigenin quruluşu
 Karbonun canlı bədənlərinin ən mühüm təməl elementi olduğunu və bu funksiyası üçün çox xüsusi quruluşla yaradıldığını araşdırdıq. Lakin karbon əsaslı bütün canlıların varlığı ikinci bir şərtdən daha asılıdır, belə ki, bu enerjidir. Enerji həyatın əvəzolunmaz ehtiyacıdır.
Karbonun canlı bədənlərinin ən mühüm təməl elementi olduğunu və bu funksiyası üçün çox xüsusi quruluşla yaradıldığını araşdırdıq. Lakin karbon əsaslı bütün canlıların varlığı ikinci bir şərtdən daha asılıdır, belə ki, bu enerjidir. Enerji həyatın əvəzolunmaz ehtiyacıdır.
Yaşıl bitkilər enerjini Günəş şüasından alarlar. Lakin heyvanlar və bizim üçün enerjinin mənbəyi "oksidləşmə": yəni yanmadır. Bitkilərdən aldığımız qidaları "yandıraraq" enerji əldə edərik. Yandırma isə oksidləşmə terminindən aydın olduğu kimi, oksidləşdirərək, yəni oksigenlə reaksiyaya daxil edərək baş verər. Məhz buna görə, oksigen də mürəkkəb həyatın su və karbon kimi təməl bir şərtidir.
Bizə enerji verən "yandırma" reaksiyasının formulu budur:
Karbon birləşmələri + oksigen > su + karbon + enerji
Yuxarıda verilmiş reaksiya nəticəsində, su və karbonla yanaşı yüksək miqdarda enerji də ortaya çıxar. Reaksiyada göstərilən karbon birləşmələrinin başında, hidrogen və karbon atomlarından ibarət karbohidrogenlər gəlir. Məsələn, qlükoza (yəni şəkər) bədənimizdə mütəmadi şəkildə yandırılaraq enerji alınan təməl bir karbohidrogendir.
İşin qəribə tərəfi, karbohidrogenləri təşkil edən hidrogen və karbon atomlarının oksidləşmə üçün ola biləcək ən uyğun atomlar olmalarıdır. Hidrogen digər bütün atomlar arasında oksidləşməyə məruz qaldıqda ən çox enerji meydana gətirən atomdur. Başqa sözlə, oksigenin yandıra biləcəyi ən yaxşı "yanacaq"dır. Karbon isə "yanacaq dəyəri" cəhətdən hidrogen və bordan sonra üçüncü yerdə gəlir. “Ətraf mühitin əlverişliliyi” kitabının müəllifi Henderson bu "fövqəladə dərəcədə faydalı uyğunlaşma" qarşısında təəccübləndiyini bildirmiş və belə yazmışdır: "Fiziologiya üçün ola biləcək ən uyğun nəticələri verən kimyəvi reaksiyalar, eyni zamanda həyata ən yaxşı enerji verən reaksiyalardır".
Odun quruluşu (niyə bir anda yanmayırıq?)
 Yuxarıda araşdırdığımız kimi, canlılar üçün enerji təmin edən ən əsas reaksiya karbon və hidrogen birləşmələrinin oksidləşməsi, yəni yanmasıdır. Lakin bu məqamda maraqlı bir sual verilə bilər: Bizim bədənimiz də əsasən karbon və hidrogen birləşmələrindən ibarətdir. Bəs niyə bədənimiz də oksidləşməz? Yaxud daha açıq desək, niyə bədənimiz bir anda kibrit çöpü kimi alovlanıb yanmaz?
Yuxarıda araşdırdığımız kimi, canlılar üçün enerji təmin edən ən əsas reaksiya karbon və hidrogen birləşmələrinin oksidləşməsi, yəni yanmasıdır. Lakin bu məqamda maraqlı bir sual verilə bilər: Bizim bədənimiz də əsasən karbon və hidrogen birləşmələrindən ibarətdir. Bəs niyə bədənimiz də oksidləşməz? Yaxud daha açıq desək, niyə bədənimiz bir anda kibrit çöpü kimi alovlanıb yanmaz?
Bədənimizin oksigenlə təmas etdiyi halda yanmaması həqiqətən, təəccüblüdür.
Bu təəccüb oyandıracaq vəziyyətin səbəbi oksigenin normal temperaturdakı molekulyar formulu olan O2 molekulunun böyük ölçüdə "təsirsiz", yəni reaksiyaya girməyən quruluşa sahib olmasıdır. Lakin bu vəziyyətdə başqa bir sual ortaya çıxar: Madam ki, O2 elə də asanlıqla reaksiyaya girməyən bir molekuldur, o zaman bu molekul bizim bədənimizdə necə reaksiyaya girir?
XIX əsrdən bəri bizi maraqlandıran bu sualın cavabı, son yarım əsrdəki inkişaflar nəticəsində məlum olmuşdur. Biokimyəvi müşahidələr insan bədənindəki bəzi xüsusi fermentlərin təkcə oksigenin atmosferdəki formulu olan O2-ni reaksiyaya daxil etməklə vəzifəsini yerinə yetirdiklərini ortaya çıxartmışdır. Hüceyrələrimizdəki bu xüsusi fermentlər olduqca mürəkkəb əməliyyatlar nəticəsində bədənimizdəki dəmir və mis atomlarından katalizator (sürətləndirici) kimi istifadə edir və beləliklə də, oksigeni reaktiv hala gətirirlər.
Yəni ortada çox maraqlı vəziyyət var: Oksigen yandırıcı elementdir və normalda bizim bədənimizi də yandırması gözlənilməlidir. Bunun qarşısını almaq üçün, oksigenin atmosferdəki formulu olan O2 qəribə şəkildə "təsirsiz" şəkildə yaradılmışdır, yəni elə də asanlıqla reaksiyaya girmir. Lakin bədənimizin enerji əldə etməsi üçün də oksigenin yandırıcılığına ehtiyacı var. Bunun üçünsə hüceyrələrimizə bu təsirsiz qazı olduqca aktiv hala gətirən mürəkkəb ferment sistemi yerləşdirilmişdir.
Həmçinin yeri gəlmişkən qeyd etmək lazımdır ki, həmin bu ferment sistemi canlıların təsadüflərlə meydana gəldiyini iddia edən təkamül nəzəriyyəsinin əsla izah edə bilmədiyi mükəmməl yaradılışdır.
Bədənimizin birdən alovlanmasının qarşısını almaq üçün alınmış digər bir başqa tədbir də var. Bu, ingilis kimyagər Nevil Sicvikin sözüylə: "karbonun səciyyəvi reaktivliyi"dir.95 Digər bir sözlə, karbon atomu da normal temperatur şəraitində elə də asanlıqla oksigenlə reaksiyaya girməz. Kimyəvi dillə ifadə edilən bu xüsusiyyətə, əslində, hamımız gündəlik həyatda çox yaxından şahid olmuşuq. Soyuq havada odun və ya kömürdən istifadə edib od yandırmağa çalışdığımız vaxt yaşadığımız çətinlik karbonun qeyd olunan "reaktivlik xassəsi"dir. Odu yandıra bilmək üçün xeyli çalışmalı, eləcə də, odunun və ya kömürün temperaturunu xeyli yüksəltməliyik. Lakin od bir dəfə alovlandıqdan sonra da, karbon sürətlə reaksiyaya girər və böyük enerji ortaya çıxar. Buna görə də, bir yanğını başlatmaq (kibrit və s. kimi xüsusi yandırma vəsaitləri olmadıqca) olduqca çətindir. Lakin yanğın bir dəfə başladıqdan sonra da, çox böyük istilik meydana gələr və bu istilik ətrafdakı digər karbon birləşmələrini də alovlandırar.
Bu vəziyyət araşdırıldıqda, əslində, odun da çox xüsusi quruluşa malik olduğu görülər. Oksigenin və karbonun kimyəvi xüsusiyyətləri elə tənzimlənmişdir ki, bunlar yalnız çox yüksək temperaturda reaksiyaya girib od meydana gətirərlər. Əgər belə olmasaydı, Yür üzünədki həyat qeyri-mümkün olardı. Əgər oksigen və karbon bir qədər daha tez reaksiyaya girsəydilər, havanın temperaturu bir qədər artdıqda insanların, ağacların, heyvanların bir anda alovlanıb yanmaları adi bir hadisəyə çevrilərdi. Məsələn, çöldə yeriyən bir insan, temperatur günorta ən yüksək həddə çatdıqda, kibrit çöpü kimi bir anda alovlara bürünə bilərdi. Bitkilər və heyvanlar da eyni təhlükəylə üzləşərdilər. Əlbəttə ki, belə bir dünyada həyatdan bəhs etmək qeyri-mümkün olardı.
Əgər oksigenin və karbonun ətalətlilik xassələri daha çox olsaydı, bu zaman da Yer üzündə od yandırmaq çox çətin, bəlkə də, qeyri-mümkün olardı. Odun olmadığı bir mühitdə isə insanların isinməsi və texnoloji avadanlıqlar meydana gətirməsi qeyri-mümkün olardı. Çünki məlum olduğu kimi texnoloji avadanlıqlar metallardan asılıdır və metallar da ancaq çox yüksək temperatur şəraitində yumşalıb forma ala bilirlər.
Bu vəziyyət, karbon və oksigenin kimyəvi xüsusiyyətlərinin də yenə insan həyatı üçün ən əlverişli şəkildə olduğunu göstərir. Maykl Denton bu mövzuda bunları yazır:
“Karbon və oksigen atomlarının normal temperatur şəraitində göstərdikləri reaksiyaya girməmə meyli bir dəfə reaksiyaya girdikləri vaxt meydana gələn nəhəng ölçüdəki enerjiylə birlikdə Yer üzündəki həyat baxımından çox əhəmiyyətli tənzimləmələrdir. Mürəkkəb canlıların mütənasib və düzgün şəkildə enerji əldə etmələrini və eyni zamanda insanların alovu idarəli şəkildə istifadə etməsi texnologiya üçün lazımi temperatur səviyyələrini əldə etməsini təmin edən şey məhz karbon və oksigendəki bu qəribə tənzimləmədir”.
Digər bir sözlə, həm karbon, həm də oksigen, bizim həyatımız üçün ən əlverişli şəkildə yaradılmışdır. Bu iki elementin xüsusiyyətləri, bizə od yandıra bilmək və bu oddan ən münasib şəkildə istifadə etmək imkanları verir. Üstəlik, dünyanın hər yeri çox bol miqdarda karbon ehtiva edən, dolayısilə atəş yandırmaq üçün asanlıqla istifadə edə biləcəyimiz ağaclarla doldurulmuşdur. Bütün bunlar odun və vəsaitlərinin də insan həyatı üçün ən əlverişli şəkildə yaradıldığını göstərir. Necə ki, Allah Quranda belə buyurmuşdur:
O sizin üçün yaşıl ağacdan od əmələ gətirdi. Budur, siz indi ondan od yandırırsınız. (Yasin surəsi, 80)
Oksigenin ideal həll olma əmsalı
Bədənimizin oksigendən istifadə edə bilməsi bu qazın suda həll olma xüsusiyyətindən qaynaqlanır. Nəfəs aldığımız vaxt ağciyərlərimizə daxil olan oksigen dərhal həll olaraq qana qarışar. Qandakı hemoqlobin adlı zülal həll olunan bu oksigen molekullarını tutaraq hüceyrələrə daşıyar. Hüceyrələrdə isə bir qədər əvvəl ifadə etdiyimiz xüsusi ferment sistemləri sayəsində bu oksigendən istifadə edilərək ATF adlandırılan karbon birləşmələri yandırılar və enerji əldə edilər.
Bütün mürəkkəb canlılar bu sistemlə enerji əldə edərlər. Lakin, əlbəttə ki, bu sistemin işləyə bilməsi, əvvəla oksigenin həll xüsusiyyətindən asılıdır. Əgər oksigen kifayət qədər həll olmasa, o, qana çox az miqdarda qarışar və bu da hüceyrələrin enerji ehtiyacının ödənilməsinə kifayət etməz. Oksigenin çox həll olunması isə qandakı oksigen miqdarını həddən artıq yüksəldər və "oksidasiya zəhərlənməsi" yaradar.
Mövzunun diqqət çəkən tərəfi isə müxtəlif qazların suda həll olma əmsallarının bir-birlərindən bir milyon qat fərqli ola bilməsidir. Yəni ən çox həll olunan qazla ən az həll olunan qaz arasında bir milyon qatlıq həll olma fərqi var. Demək olar ki, heç bir qazın həll olma əmsalı eyni deyil. Məsələn, karbon oksigenlə müqayisədə suda iyirmi qat daha çox həll olar. Bu qədər müxtəlif həll olma əmsalları arasında oksigenin həll olma əmsalı isə tam bizim üçün uyğun olan əmsaldır.
Görəsən oksigenin həll olma əmsalı bir qədər daha az və ya çox olsa nə baş verərdi?
Əvvəlcə birinci ehtimala baxaq. Əgər oksigen suda (və dolayısilə qanda) bir qədər daha az həll olsa qana daha az oksigen qarışar və hüceyrələr kifayət qədər oksigen ala bilməz. Belə olan halda, insan kimi yüksək maddələr mübadiləsi sürətinə sahib canlıların yaşaması çox çətinləşər. Belə olduqda, nə qədər çox nəfəs alsaq da havadakı oksigen hüceyrələrə kifayət qədər çatmayacağı üçün yavaş-yavaş boğulma təhlükəsi ilə üzləşərik.
Əgər oksigenin həll olma əmsalı daha çox olsa bu dəfə isə bir qədər əvvəl ifadə etdiyimiz "oksidasiya zəhərlənməsi" baş verər. Oksigen, əslində, çox təhlükəli qazdır və normadan artıq qəbul edildikdə canlılar üçün öldürücü təsirə malikdir. Qandakı oksigen miqdarı artdıqda bu oksigen su ilə reaksiyaya girərək olduqca reaktiv və zərərli tullantılar ortaya çıxardar. Bədəndə oksigenin bu təsirini aradan qaldıran olduqca mürəkkəb ferment sistemləri var. Lakin oksigen miqdarı bir qədər daha artsa, bu ferment sistemləri işə yaramayacaq və aldığımız hər nəfəs bədəni bir qədər daha zəhərləyərək bizi qısa müddətdə ölümə aparacaq. Kimyaçı İrvin Fridoviç bu mövzuda belə söyləyir:
“Tənəffüs edən bütün orqanizmlər qəribə bir tələyə düşüblər. Həyatlarını dəstəkləyən oksigen, eyni zamanda onlar üçün zəhərləyici (toksik) xüsusiyyətdədir və bu təhlükədən yalnız çox həssas olan bəzi xüsusi müdafiə mexanizmləri sayəsində qorunurlar”.
Məhz bizi bu tələdən, yəni oksigenlə zəhərlənmə və ya oksigensiz qalaraq boğulma təhlükələrindən qoruyan şey oksigenin həll olma əmsalının və bədəndəki mürəkkəb ferment sistemlərinin tam lazım olduğu şəkildə müəyyənləşdirilmiş və yaradılmış olmasıdır. Daha açıq desək Allah tənəffüs etdiyimiz havanı da, bu havadan istifadə etməyimizi təmin edən sistemlərimizi də mükəmməl şəkildə yaratmışdır.
Digər elementlər
Şübhəsiz ki, həyat üçün xüsusi olaraq yaradılmış elementlər karbon və oksigenlə məhdudlaşmır. Eləcə də, canlı bədənlərinin böyük hissəsini təşkil edən hidrogen, azot kimi elementlər də canlıların yaşamasına imkan verəcək müəyyən xüsusiyyətlərə malikdirlər. Bunlardan savayı, dövri cədvəldə olan bütün elementlərə, əslində, bu və ya digər şəkildə, həyata dəstək olmaları üçün xüsusi tapşırıqlar verilmişdir.
Dövri cədvəldə hidrogendən urana qədər 92 element mövcuddur (urandan sonrakı elementlər təbiətdə mövcud deyillər, dövrümüzdə laboratoriyada meydana gətirilirlər və onsuz da qeyri-stabildirlər). Bu 92 elementdən 25-i bilavasitə həyat üçün zəruridir. Bunların 11-i, yəni, hidrogen, karbon, oksigen, azot, natrium, maqnezium, fosfor, kükürd, xlor, kalium və kalsium, canlı orqanizmlərin təxminən 99,9%-ni meydana gətirən təməl elementlərdir. Bunlardan savayı 14 element, yəni, vanadium, xrom, manqan, dəmir, kobalt, nikel, mis, sink, molibden, bor, silikon, selen, flüor və yod isə canlıların bədənində çox az miqdarda mövcuddur, lakin mühüm funksiyalar yerinə yetirirlər. Bunlardan başqa arsen, qalay və volfram da bəzi orqanizmlərdə mövcuddur və bir hissəsi sirri tam açılmamış funksiyalar yerinə yetirirlər. Brom, stronsium və barium kimi daha üç elementin canlı orqanizmlərin əksəriyyətində olduğu məlumdur, lakin funksiyaları hələ də aydınlaşmamışdır.
Bu geniş çərçivə dövri cədvəlin müxtəlif qruplarına bağlı atomları ehtiva edir (dövri cədvəldə atomları xüsusiyyətlərinə görə ayıran qruplar var). Bu vəziyyət isə dövri cədvəldə müxtəlif element qruplarının hamısının müəyyən şəkildə həyat üçün istifadə edildiyini göstərir. J. Frausto da Silva və R. Uilyams “Elementlərin biokimyası” (“The Biological Chemistry of The Elements”) adlı kitablarında belə yazırlar:
“Bioloji elementlər dövri cədvəlin hər qrupundan və alt qrupundan diqqətlə seçilmiş kimi görünürlər və bu da hər cür kimyəvi xüsusiyyətin ətraf mühit şərtlərinin qoyduğu sərhədlər çərçivəsində həyat funksiyaları ilə bağlı olduğunu göstərir”.
Dövri cədvəlin ən sonunda yerləşən radioaktiv elementlər isə daha dolayı yolla da olsa yenə insan həyatına xidmət edərlər. Maykl Denton “Təbiətin taleyi” adlı kitabında ətraflı şəkildə qeyd etdiyi kimi, həmin bu radioaktiv elementlər, məsələn, uran Yerin geoloji quruluşunun formalaşmasında böyük rol oynamışdır. Yerin nüvəsindəki istiliyin qorunub saxlanmasının radioaktivliklə yaxından əlaqəsi var. Bu istilik sayəsində Yerin nüvəsində maye halında dəmir toplanır və Yer kürəsinin maqnit sahəsi bu sayədə qorunur. Dövri cədvəldə həyat üçün təsirsiz kimi görünən təsirsiz qazlar və nadir torpaq metalları isə atom meydana gətirmə əməliyyatının urana qədər davam edə bilməsi üçün, keçilməsi lazım gələn zəruri pillələrdir.
Bir sözlə, kainatda mövcud olduğunu bildiyimiz bütün elementlər insan həyatına müəyyən şəkildə xidmət edirlər. Heç biri boşuna və məqsədsiz yaradılmayıb. Bu vəziyyət kainatın Allah tərəfindən insan üçün yaradıldığını göstərən digər bir dəlildir.
Nəticə
Kainatın araşdırılan istənilən fiziki və ya kimyəvi xüsusiyyətinin, həyat üçün tam əlverişli olduğu ortaya çıxır. Araşdırmalar nə qədər artırılsa da, bu ümumi qanun dəyişmir. Kainatın istənilən yerində insan həyatı üçün yaradılmış bir məqsəd və bu məqsədə dair mükəmməl uyğunluq, nizam və tarazlıq var.
Əlbəttə ki, bu, kainatı bu məqsədlə yaratmış üstün bir Yaradıcının varlığının sübut edir. Maddənin hansı xüsusiyyətini araşdırsaq belə, yenə maddəni yoxdan yaratmış Allahın sonsuz bilik, ağıl və qüdrətini görərik. Hər şey Onun iradəsinə boyun əymişdir və dolayısilə hər şey mükəmməl uyğunluq içindədir.
XX əsr elminin gəldiyi bu nəticə isə yenə insanlara Quranda bildirilmiş bir həqiqətin təsdiqidir. Allah kainatın istənilən incəliyinin yaratmasının mükəmməlliyini göstərdiyini Quranda insanlara belə bildirmişdir:
Mülk Əlində Olan Allah nə qədər Ucadır. O hər şeyə qadirdir. Əməl baxımından hansınızın daha yaxşı olduğunuzu sınamaq üçün ölümü və həyatı yaradan Odur. O, Üstün və Güclüdür, çox Bağışlayandır. Yeddi göyü bir-birinə tam uyğun olaraq təbəqələr şəklində quran Odur. Sən Mərhəmətli Allahın yaratdığında qətiyyən bir uyuşmazlıq tapmazsan. Bir göz gəzdirib bax, hər hansı bir çat görürsənmi? Sonra iki dəfə də, göz gəzdirib bax. Göz (uyğunsuzluq tapmaqdan) ümidini kəsmiş və yorğun halda özünə tərəf dönəcək. (Mülk surəsi, 1-4)

